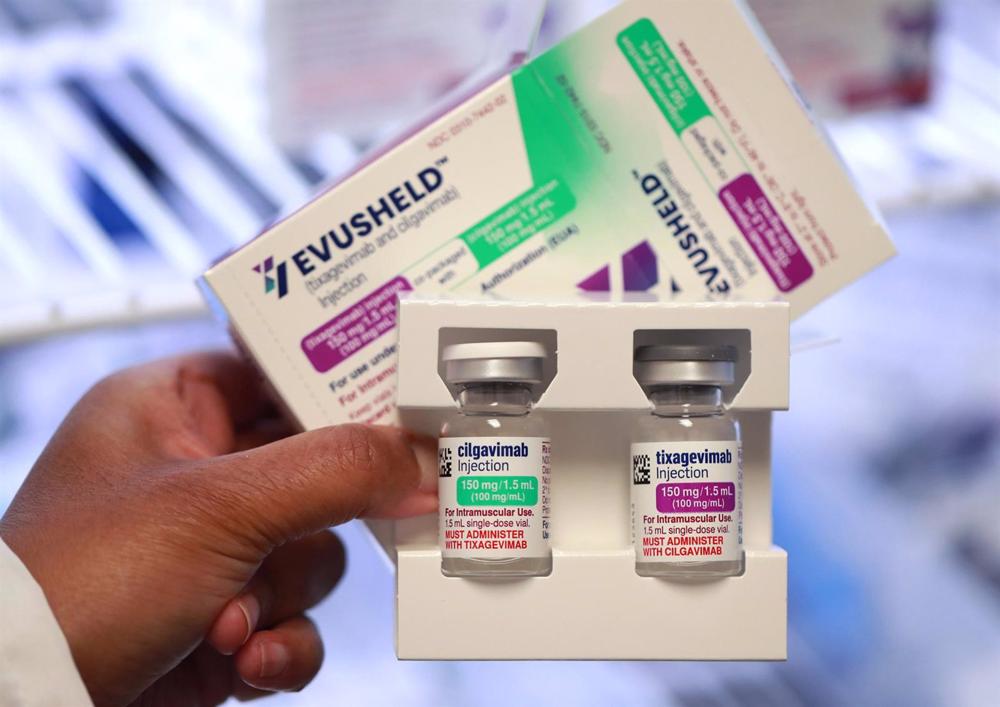
La Food and Drug Administration (FDA) a déclaré vendredi que la variante XBB.1.5 du coronavirus est susceptible d’être résistante à l’Evusheld, le médicament COVID-19 d’AstraZeneca.
Selon la FDA, l’antiviral de la société pharmaceutique britannique pourrait ne pas offrir de protection contre le développement du COVID-19 aux personnes qui le reçoivent et sont ensuite exposées à la nouvelle variante.
Evusheld était le dernier anticorps de sa catégorie encore autorisé aux États-Unis pour prévenir l’infection chez les personnes à haut risque, car tous les autres médicaments avaient été écartés en raison de la forte probabilité qu’ils ne protègent pas contre les nouvelles variantes.
Les thérapies par anticorps ont été essentielles pour traiter et prévenir les maladies chez environ sept millions d’Américains immunodéprimés pour lesquels les vaccins et les antiviraux sont moins efficaces, selon Bloomberg.
Cependant, à mesure que le virus COVID-19 a muté, il a retiré les anticorps du marché un par un.
Actuellement, le XBB.1.5, qui provient d’Omicron, représente 28 % de toutes les variantes en circulation aux États-Unis, selon les données de la FDA.
Le directeur général de l’Organisation mondiale de la santé (OMS), Tedros Adhanom Ghebreyesus, a déclaré que l’agence sanitaire internationale évaluait l’augmentation rapide de la variante XBB.1.5 aux États-Unis et dans 24 autres pays.
M. Tedros s’est dit «très préoccupé» par le tableau épidémiologique actuel du COVID-19, «à la fois en raison de l’intensité de la transmission dans diverses parties du monde et de la propagation rapide d’une sous-variante recombinante».
À cet égard, il a assuré que l’OMS «suit de près et évalue le risque de cette sous-variante et fera rapport en conséquence» sur les nouvelles données.
Source: (EUROPA PRESS)






